Современные линейные электронные ускорители для лечения онкологических больных — это настоящая революция по сравнению с гамма-облучением прошлого века. Такие установки есть лишь в нескольких российских медицинских центрах. Новые системы позволяют вращать компактный излучатель пациента и с высокой точностью направлять луч в опухоль. Они оснащены компьютерными программами, которые по томографическому изображению органов и тканей разрабатывают схему облучения. Например, если в поле гамма-луча попадает критический орган, луч прерывается, не повреждая его. Облучение с разных сторон уменьшает дозовую нагрузку на здоровые ткани, а в опухоли накапливает ее до летальной.
Однако по эффективности гамма-приборы даже нового поколения заметно уступают установкам научно-исследовательских институтов — ускорителям адронов (протонов и тяжелых ионов). Практикующая медицина в России такими ускорителями не располагает вовсе. Некоторые из протонных ускорителей Института теоретической и экспериментальной физики в Москве и Объединенного института ядерных исследований в Дубне используются для лечения пациентов. Но силами научных институтов удается выполнить не более 0,1% требуемых операций.
— Основной недостаток гамма-излучения заключается в его постепенном ослаблении по мере прохождения через ткани, — говорит заведующий лабораторией ИЯФ им. Г. И. Будкера СО РАН Василий Пархомчук. — Максимум приходится на начало пути, а после поражения клеток мишени он затухает не мгновенно, так что здоровые ткани перед опухолью и за ней получают большую дозовую нагрузку. Адронные пучки — протоны и тяжелые ионы, способны выдать максимум дозы в конце своего пути, после чего доза резко уменьшается. Это физическое явление называется пиком Брэгга. Глубина расположения пика Брэгга в теле пациента легко регулируется изменением энергии пучка.

В лаборатории члена-корреспондента РАН Василия Пархомчука разрабатываются методы лечения рака ионными пучками
Фото: Мария Роговая, Коммерсантъ
Еще одно важное преимущество ионного облучения — высокая относительная биологическая эффективность (ОБЭ). Клеточная ДНК надежнее разрушается тяжелыми частицами (ионами), поэтому для уничтожения раковой клетки протонным излучением требуется физическая доза в полтора раза меньше, чем для гамма-лучей, а для облучения тяжелыми ионами — в 3-4 раза меньше. Высокая ОБЭ особенно важна для лечения онкологии у детей, когда отдаленные последствия облучения играют принципиальную роль.
— Пучки тяжелых ионов разрушают раковую клетку прямым воздействием — частица разрывает двойную нить ДНК, не оставляя ей никаких шансов на восстановление-репарацию, — объясняет замдиректора ИЯФ им. Г. И. Будкера СО РАН Евгений Левичев. — Механизм действия протонного пучка более опосредованный, и в этом он ближе к гамма-излучению — и тот, и другой ионизует клеточную плазму, создавая в ней свободные радикалы, которые химически разрушают ДНК опухолевой клетки. При таком способе контроль над процессом меньше. А для уничтожения некоторых видов опухолей гамма-облучение и даже протоны вообще неэффективны, и надежда может быть только на ионные пучки.
Для ионного терапевтического комплекса в Японии ИЯФ СО РАН разработал и изготовил основной "скелет" установки — магниты, направляющие пучок, выиграв в 2009 году международный конкурс. В этом году институт получил такой же заказ из Австрии. На очереди — Китай, где в Институте современной физики в Ланчжоу единственная специализированная протонная установка не работает, зато успешно функционирует научный ионный комплекс, спроектированный и созданный с участием сибирских физиков. За полтора года работы на нем получили лечение более ста пациентов.
Еще одно современное направление в медицинских лучевых технологиях — борнейтронзахватная терапия — позволяет уничтожать диффузные опухоли с нечеткими границами и множественными очагами. Клинические испытания борнейтронзахватной терапии впервые были проведены еще в 70-е годы на ядерных реакторах в университетах Осаки и Киото (Япония) и показали потрясающий эффект, в особенности при лечении глиобластомы мозга. На этих реакторах успешно прошли лечение уже многие пациенты. Подобное оборудование работает и в одном из научных центров Финляндии. Стоимость сеанса облучения примерно 40 тыс. евро.
Хотя в мире работают сотни ядерных реакторов, исследовательских реакторов, на которых можно проводить такие работы, не более десяти, а для медицинских целей и вовсе используются единицы. Ведь ядерный реактор не приспособлен для практической медицины. Он весит сотни тонн, требует специальных систем безопасности и дорогостоящего обслуживания, а его создание и утилизация обходятся в миллиарды долларов.
Ученым ИЯФ им. Г. И. Будкера СО РАН в Новосибирске удалось создать компактный генератор нейтронов на основе мощного протонного ускорителя — прототип будущей медицинской установки. Нигде в мире нет ускорителя, позволяющего получить пучок протонов, который после сброса на литиевую мишень превращается в нейтронный пучок. Здесь, на недавно созданной биологической станции, проводят исследования специалисты Центра нейрохирургии НИИПК им. Е. Н. Мешалкина и Института цитологии и генетики СО РАН. Клиника предоставляет клетки злокачественной глиобластомы мозга, сотрудники ИЦиГ культивируют их в своих лабораториях, а затем полученную ткань облучают в ускорителе.
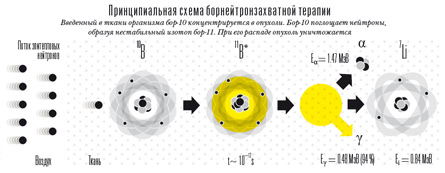
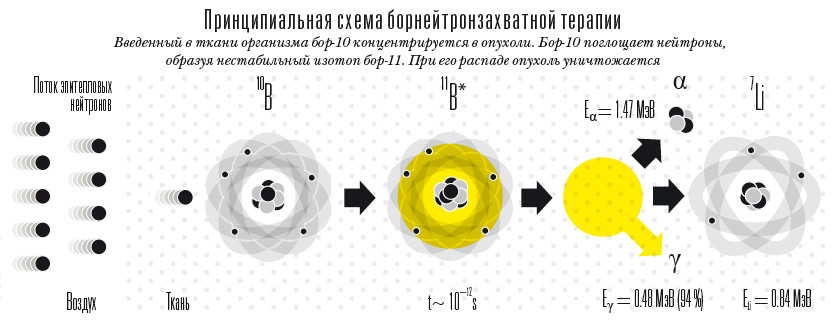
Принципиальная схема борнейтронзахватной терапии
Принципиальная схема борнейтронзахватной терапии
Фактически ученые производят в каждой раковой клетке микроскопический ядерный взрыв. Для этого в ткани сначала вводят безвредный для живого организма изотоп бор-10, который концентрируется именно в опухоли. Бор-10 поглощает нейтроны, даже когда они движутся от него на расстоянии в сто раз большем, чем размер ядра бора. При поглощении нейтрона образуется нестабильный изотоп бор-11, который тут же распадается. Образующиеся осколки — медленные ядра лития и альфа-частицы — проходят очень малый путь, но с огромной ионизирующей способностью. Не выходя за пределы клетки, они практически "выжигают" ее изнутри.
Борнейтронзахватная терапия сделала возможным лечение глиобластом — опухолей головного и спинного мозга, на которые не действовала ни одна имеющаяся терапия. Количество исцеленных пациентов в мире с этими диагнозами увеличилось на порядок, случаи рецидивов не зафиксированы. Руководитель Центра нейрохирургии НИИПК им. Е. Н. Мешалкина Алексей Кривошапкин объяснил, почему эксперименты в ИЯФ СО РАН сегодня ведутся именно на глиобластоме, хотя нет никаких ограничений в использовании этой технологии на других видах опухолей.
— При остальных онкологических заболеваниях в мире в среднем уже излечиваются около 60% пациентов, — говорит нейрохирург. — Продолжительность их жизни превышает пять лет — общепринятый показательный рубеж в мировой медицинской практике. В лечении глиобластомы успехи заметно слабее. Сегодня исцелившихся всего 12,9%, а выживаемость после лечения составляет четыре года. Но даже эти цифры вселяют во врачей всего мира надежду, ведь еще совсем недавно излечившихся от этого заболевания было в десять раз меньше, а сроки их выживаемости исчислялись месяцами.
Нейтронный генератор для терапии рака в мире уже есть — он создан в Японии компанией Shimamutsu. Но, по словам одного из разработчиков установки в ИЯФ СО РАН Сергея Таскаева, это дорогой и совсем не оптимальный вариант источника нейтронов. Он существенно проигрывает проекту ИЯФа из-за высокой стоимости и качества нейтронного пучка. Энергия нейтронов у японцев намного выше, что требует громоздкого оборудования для замедления пучка. Зато японский источник базируется на надежных, проверенных технологиях и позволит уже в самое ближайшее время начать отработку методики в клинической практике. Цена японского агрегата составила 18 млн долларов.
Необходимость госпрограммы по организации радиологических центров с применением адронной лучевой терапии очевидна. Вопрос лишь в том, станет ли Россия закупать готовую импортную технику или будет адаптировать собственные ядерные технологии к медицинской практике. По стоимости российский протонный ускоритель с учетом своих "ноу-хау" примерно совпадает с импортным — 10 млн долларов, а общая цена вопроса вместе с комплексом зданий — около 30 млн долларов. Первый шаг сделан в сторону импорта — центр лучевой терапии в Димитровграде решением правительства РФ оборудуют бельгийскими ускорителями IBA. На первом этапе это позволит быстрее приступить к лечению онкобольных. Но если и дальше действовать по схеме закупки импорта, в загоне окажется развитие многих научных направлений в России: ядерные технологии, радиология, медицина и микробиология. Сегодня проекты российских ядерщиков выигрывают зарубежные тендеры. Купить готовые установки проще, но это будут инвестиции в иностранные технологии, а наши разработчики продолжат работать на экспорт, помогая лечить пациентов Японии, Китая и Европы.


