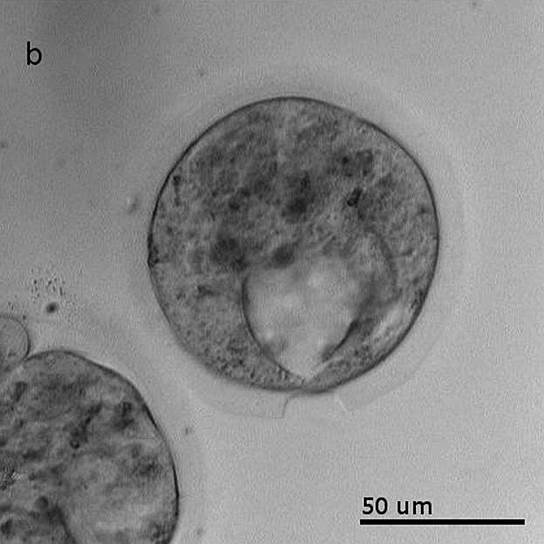
Низкотемпературные лазерные скальпели, разработанные в Объединенном институте высоких температур РАН, могут значительно повысить эффективность бесконтактной микрохирургии при лечении бесплодия.

Установка для низкотемпературной лазерной хирургии, разработанная в Объединенном институте высоких температур РАН
Фото: ОИВТ РАН
От ЭКО в пробирке до лазера
Современное искусственное оплодотворение включает в себя множество вспомогательных репродуктивных технологий (ВРТ). Если их родоначальник — метод экстракорпорального оплодотворения (ЭКО) с последующей подсадкой эмбриона в матку решал только часть проблем, в частности непроходимость фаллопиевых труб у женщин, то современные ВРТ и прежде всего микрохирургия значительно расширили возможности методик, и теперь они могут помочь значительно большему числу супружеских пар, страдающих бесплодием.
Преимплантационная генетическая диагностика эмбриона:
Микрохирургические методы эффективны при выборе и иммобилизации самого качественного сперматозоида при патологиях спермы и при вспомогательном хэтчинге, то есть искусственном истончении или просто удалении части блестящей (внешней) оболочки яйцеклетки. Если она чересчур толстая или слишком прочная, то зародыш не может из нее вылупиться, чтобы прикрепиться к стенке матки. Также микрохирургия эмбриона используется для его преимплантационной ДНК-диагностики, чтобы гарантировать отсутствие возможных генетических нарушений у будущего младенца.
Обычно в современных клиниках для микрохирургии эмбриона используют механический микроманипуляционный способ. Эмбриолог при помощи специального микроманипулятора и тонких стеклянных микроинструментов под микроскопом проводит эти сложные процедуры. Каждая операция остается в своем роде уникальной, полностью автоматизировать манипуляции хирурга невозможно.
Биопсия полярного тельца (ПТ):
12 лет назад в арсенале микрохирурга появились лазерные скальпели. Они встроены в рабочий инструмент эмбриолога — инвертированный микроскоп, как правило, с видеокамерой. Объектив микроскопа используется для фокусировки лазерного излучения в пятно диаметром несколько микрометров.
Условно эти системы можно разделить на два поколения: пассивные и активные. В первых лазерный луч неподвижен, и микрохирург вручную подводит эмбрион к области лазерной фокусировки. Это удобнее, чем "ковыряние" стеклянной иглой, но автоматизация процесса невозможна.
Второе поколение, появившееся около пяти лет назад, с управляемым лазерным лучом, позволяет в известной мере автоматизировать микрохирургические процедуры. Хирург намечает область (или несколько областей) лазерного воздействия на изображении эмбриона на экране персонального компьютера и запускает процедуру.
Сегодня в клинической практике лазер применяется в основном для выполнения лишь одного этапа процедуры биопсии — для формирования отверстия в оболочке эмбриона, последующий забор клеточного материала осуществляется вручную с помощью микропипеток.
Ультракороткая длительность лазерного импульса в сочетании с малой энергией обеспечивают максимальную безопасность при воздействии на биологические объекты
Слишком высокая температура
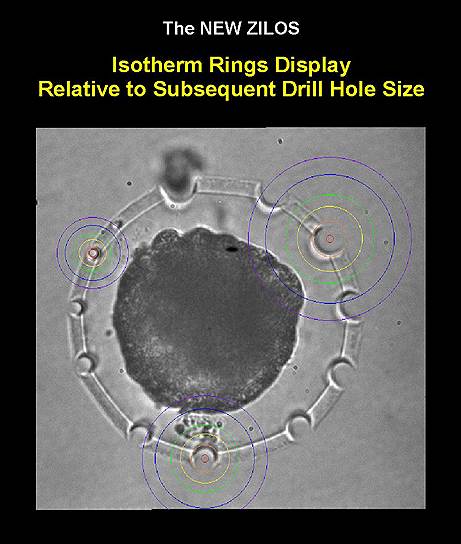
Отличительной особенностью упомянутых выше лазерных систем является большая длительность лазерного импульса — микро- и даже миллисекунды. При этом температура в зоне фокусировки луча диаметром несколько микрометров может достигать несколько десятков и даже сотни градусов и сопровождается переносом тепла в прилегающие области. Программное обеспечение некоторых лазерных систем позволяет рассчитать температуру вне области лазерной фокусировки в зависимости от параметров лазера — мощности и длительности импульса. Рассчитанные изотермы в виде концентрических окружностей накладываются поверх изображения эмбриона, что позволяет специалисту оценить риски термического воздействия на эмбрион.
Все это заставляет применять лазерные системы с большой осторожностью. На международной конференции "Репродуктивные технологии сегодня и завтра", которую ежегодно проводит Российская ассоциация репродукции человека, мне рассказывали о случаях обугливания отбираемых клеток используемыми лазерами. Было понятно, что изменить ситуацию может радикальное снижение температуры в зоне фокусировки лазерного луча.
На процедуру — 10-13 секунды
Наша команда из лаборатории лазерного воздействия Объединенного института высоких температур РАН поставила себе цель создать бесконтактный инструмент, безопасный для эмбриона и удобный для эмбриологов.
Бесконтактный — в буквальном значении: исключающий прикосновение инструмента (иглы, пипетки, холдера) к эмбриону. Как уже сказано, даже при использовании лазерного скальпеля в процедуре биопсии последующий забор клеточного материала осуществляется механически вручную с помощью микропипеток. Технологии оптического манипулирования позволяют отказаться от использования механических средств и выполнять забор клеточного материала для генетической диагностики с помощью сфокусированного непрерывного лазерного излучения ("оптического пинцета").
А понизить температуру в зоне фокусировки лазерного луча должна была замена лазерного источника с микросекундного на фемтосекундный. Типичная длительность коммерчески доступного фемтосекундного лазера составляет порядка 100 фемтосекунд, что в десять миллионов раз короче импульса длительностью в 1 микросекунду. Ультракороткая длительность лазерного импульса в сочетании с малой энергией (примерно на два порядка меньше, чем энергия микросекундного импульса) делают его уникальным при воздействии на биологические объекты — малая энергия означает малый нагрев, а следовательно, максимальную безопасность.
Вследствие гигантской пиковой мощности в основе воздействия фемтосекундных лазерных импульсов лежат нелинейные оптические эффекты, за счет которых достигается высокая точность проводимых процедур, а также минимизируется риск повреждения живых тканей и клеток, так как поглощение излучения и нагрев вне области воздействия сфокусированного лазерного пучка практически отсутствуют.
Сочетание лучших черт технологий в области лазерного приборостроения позволило создать нашей команде комбинированную систему "фемтосекундный лазерный скальпель — оптический пинцет" (первый на основе фемтосекундного лазера, второй — непрерывного лазера). Система лазерный пинцет--скальпель (ЛПС, так мы ее назвали для краткости) позволяет выполнять в полностью бесконтактном режиме наиболее трудоемкие и деликатные процедуры, сохраняя стерильность и снижая риск повреждения эмбриона.
Создать экспериментальный прибор мало, важно научиться с его помощью выполнять микрохирургические и микроманипуляционные процедуры
Не плавя, а разрезая
Создать экспериментальный прибор (аппаратную часть) мало, важно научиться с ее помощью выполнять микрохирургические и микроманипуляционные процедуры, выполняемые эмбриологом. Сделать управление такой комбинированной системой не сложнее программирования стиральной машины — вот задача, которая ставилась нами во главу угла при разработке автоматизированных процедур.
Вспомогательный хэтчинг и истончение блестящей оболочки были первыми процедурами, разработанными с использованием ЛПС. Объектом для отработки этой и других микрохирургических процедур стали эмбрионы мыши. Неоценимую помощь при работе с эмбрионами нам оказала группа специалистов под руководством профессора Марии Львовны Семеновой с кафедры эмбриологии МГУ им. М.В. Ломоносова — кандидат биологических наук Юлия Храмова и аспирант Максим Филатов.
Начав работу с фемтосекундными импульсами, мы сразу увидели отличие в результате. Лазерный скальпель в прямом смысле оправдал свое название — мы смогли выполнять тончайшие разрезы оболочки, не плавя, а разрезая ее.
Еще одной особенностью нашей технологии стала возможность проведения процедуры вспомогательного хэтчинга на поздних стадиях развития эмбриона, когда клетки изнутри вплотную прилегают к блестящей оболочке. И эти клетки не погибали!
Более сложной с технической точки зрения является процедура биопсии полярного тельца, которую мы провели в полностью бесконтактном режиме. Для этого мы задействовали все возможности нашей системы ЛПС: и лазерный скальпель, и оптический пинцет. Процедура состоит из нескольких этапов: разрезания блестящей оболочки и захвата оптическим пинцетом полярного тельца с извлечением последнего за пределы эмбриона.
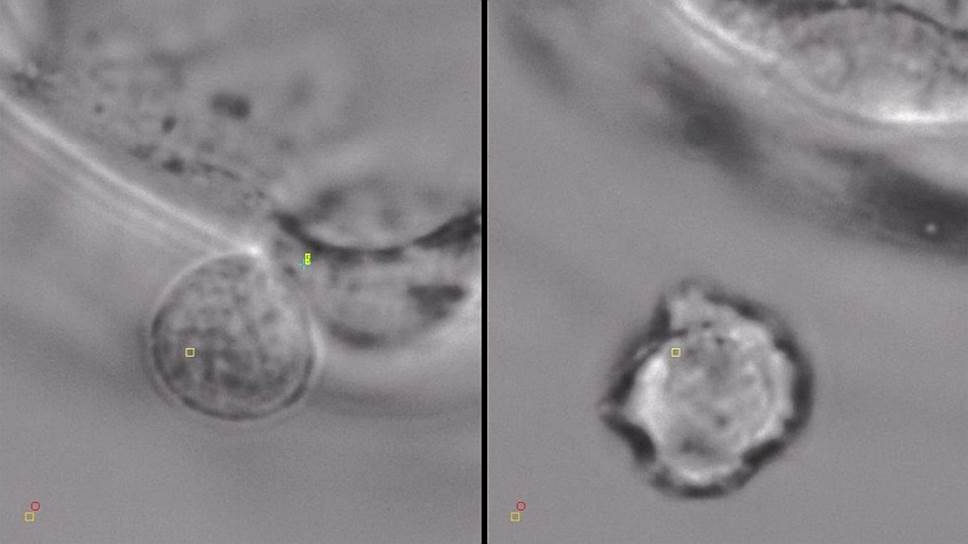
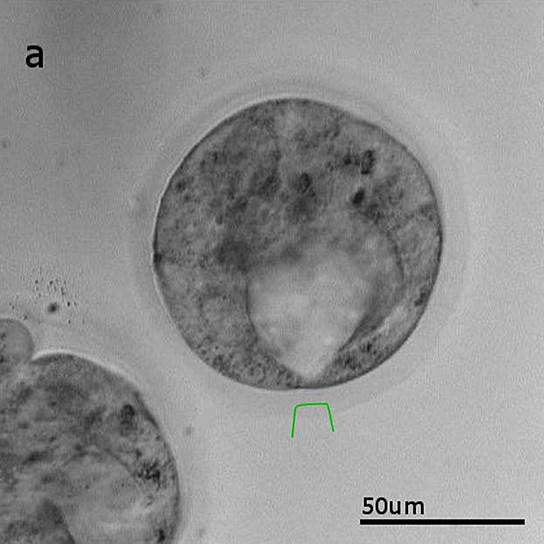
Биопсия трофэктодермы (поверхностного слоя клеток эмбриона) на стадии бластоцисты (на пятый день после оплодотворения). Слева участок блестящей оболочки на стадии хэтчинга, справа отсеченная часть трофэктодермы, захваченная оптическим пинцетом
Фото: Дмитрий Ситников
При нормальном развитии эмбриона первыми блестящую оболочку покидают клетки трофэктодермы, которые впоследствии входят в состав плаценты вокруг плода. Задача процедуры биопсии трофэктодермы состоит в том, чтобы отделить часть этих клеток для последующего генетического анализа. Так как хэтчинг (вылупление) происходит через тонкий разрыв блестящей оболочки и в начале этого процесса наружу выходит маленький участок трофэктодермы, то достаточно воздействия одного-двух лазерных импульсов для отделения этих клеток (биоптата). Для захвата отсеченных клеток мы используем оптический пинцет. В клиниках при выполнении данной процедуры с помощью миллисекундных лазерных импульсов приходится оттягивать клетки трофэктодермы подальше от клеток эмбриона при помощи специальной стеклянной микропипетки, чтобы минимизировать термическое воздействие на эмбрион.
Впереди еще долгий путь сертификации и клинических испытаний. В настоящий момент мы только начинаем тесное сотрудничество с клиниками в области разработки новых технологий и адаптации существующих, но в конечном итоге выиграют все участники — и клиники, и будущие родители.
Работы выполнены при поддержке Минобрнауки РФ в рамках ФЦП "Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014-2020 годы".
Помощь нужна пяти миллионам пар
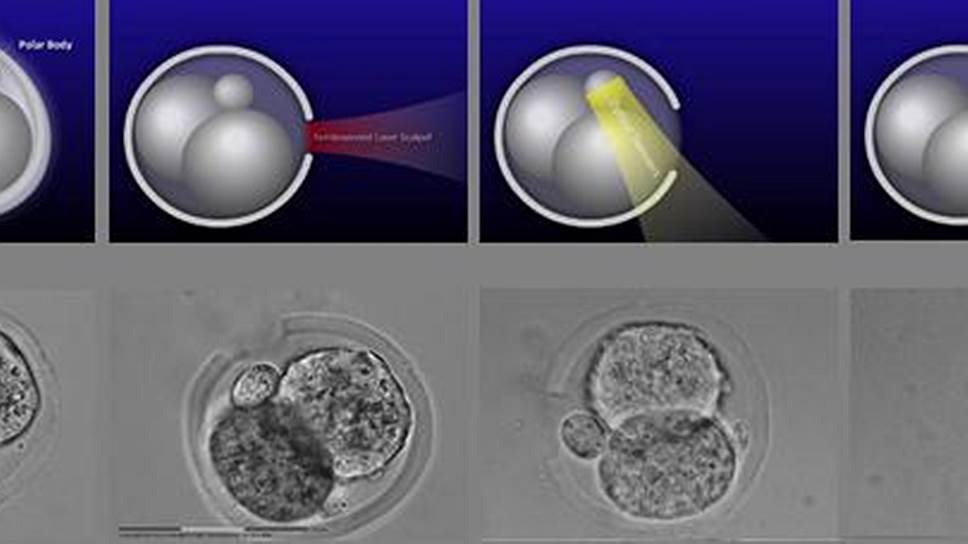
Бесконтактная биопсия полярного тельца. Слева направо: эмбрион до биопсии, формирование отверстия во внешней оболочке эмбриона с помощью лазерного скальпеля, захват и извлечение полярного тельца с помощью оптического пинцета. Красный луч — лазерный скальпель, желтый луч — оптический пинцет
Фото: Дмитрий Ситников
Частота бесплодных браков в России превышает 15%, что, по данным Всемирной организации здравоохранения, считается критическим уровнем. В стране зарегистрировано более 5 млн супружеских пар, страдающих бесплодием, из них более половины нуждаются в использовании вспомогательных репродуктивных технологий. По данным ВОЗ, только показатель женского бесплодия за последние пять лет увеличился на 14 %.