Биологический факультет МГУ им. М.В. Ломоносова и Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского создали и успешно испытали на животных трансплантаты для кишечника из белка шелка тутового шелкопряда фиброина, заселенные стволовыми клетками костного мозга.

Белок шелка тутового шелкопряда Bombyx mori обладает целым рядом уникальных свойств, делающих его незаменимым в медицине
Фото: Biosphoto / Kerstin Hinze/ AFP
Матрикс трансплантата
Трансплантация донорских тканей и органов сопряжена с рядом трудностей, главная из которых — нехватка донорского материала. Дефицит донорских тканей и органов стимулировал развитие тканевой инженерии, разрабатывающей биоискусственные заменители донорского материала. Основа таких заменителей — каркасы (скаффолды), имитирующие бесклеточную составляющую соединительной ткани. На поверхности скаффолдов размножаются и дифференцируются тканеспецифичные клетки, в результате чего формируется ткань, близкая по свойствам к утраченной.
Первые попытки заселить скаффолды клетками относятся к 1980-м годам, когда для выращивания ткани кишечника на биоразлагаемых полимерах были использованы энтероциты. Тогда же возник вопрос об использовании в регенеративной медицине стволовых клеток различного происхождения. Дальнейшие исследования показали, что стволовые клетки, циркулирующие в кровяном русле, и стволовые клетки костного мозга могут дифференцироваться в разные типы клеток: гепатоциты, эпителиальные клетки кожи и клетки желудочно-кишечного тракта. Это позволило высказать предположение о целесообразности использования стволовых клеток в тканеинженерных конструкциях.
Сегодня в практике регенеративной медицины источником клеток, формирующих ткань таких конструкций, служат как уже дифференцированные (зрелые) клетки, мигрирующие из окружающих тканей, так и прогениторные клетки-предшественники, то есть та разновидность стволовых клеток, которые уже нацелены на дифференцировку в определенный вид клеток.

Скаффолд (каркас) имплантата из белка шелка тутового шелкопряда — фиброина, из которого выкраивают "заплатки" для кишечника
Фото: Из личного архива Анны Гончаренко
Опасности "золотого стандарта" кишечной трансплантологии
Одна из серьезных медицинских проблем — последствия удаления части кишечника. Обширная его резекция приводит к нарушению всасывания питательных веществ и жидкости, развивается диарея, обезвоживание и прогрессивное истощение. На сегодняшний день наиболее реальной помощью пациентам, нуждающимся в обширной резекции кишечника или страдающим от ее последствий, является трансплантация тканеинженерного кишечника.
"Золотым стандартом" таких операций считается использование имплантатов на основе ксеногенного децеллюляризованного тонкого кишечника (из которого удалены все клетки и сохранен внеклеточный матрикс). А ксеногенным (чужеродным) донорский орган называют потому, что его берут у животных, обычно у свиньи.
Однако данный метод связан с риском заражения организма реципиента патогенами из биоматериала трансплантата. В качестве доноров используют беспатогенных животных, но так можно избежать только бактериального инфицирования, но не риска инфицирования эндогенными ретровирусами свиньи (PERV) и свиного цитомегаловируса (PCMV), способными заражать клетки человека.
Представляют опасность и вирусы, пока циркулирующие только у животных, например, свиные цирковирусы типов 1 и 2, вирус, вызывающий репродуктивно-респираторный синдром, свиной вирус энцефаломиокардита, вирус свиного гриппа, вирус африканской лихорадки, вирус гепатита Е, вирус герпеса, парвовирусы и свиные полиомавирусы. Вирусы могут приобретать новые свойства при трансплантации вследствие мутаций и рекомбинации с человеческими вирусами.
В связи с этим постоянно ведется поиск материалов для тканевой инженерии кишечника.
Идеальный матрикс
Одним из перспективных материалов для создания биоискусственных тканей является фиброин — каркасный белок шелка тутового шелкопряда Bombyx mori. Шелк широко используется в медицине в качестве шовного материала и обладает рядом уникальных свойств — механической прочностью, биосовместимостью с тканями организма (не вызывает иммунологического отторжения, не токсичен) и, что очень важно, способностью к биорезорбции, то есть со временем он разрушается клетками организма и продукты его распада естественным образом метаболизируются организмом.
Ряд исследований показал, что фиброин является хорошим субстратом для закрепления на нем (адгезии) и разрастания (пролиферации) разных типов клеток, и на его основе возможно создание скаффолдов разной структуры, заданных форм и размеров.
На биологическом факультете МГУ им. М.В. Ломоносова в сотрудничестве с хирургами Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского был проведен ряд успешных экспериментов по использованию фиброиновых скаффолдов, предварительно заселенных (витализированных) стволовыми клетками костного мозга для регенерации стенки тощей кишки на модели травмы стенки тощей кишки крысы.
У экспериментальных животных вырезали фрагмент тощей кишки размером 0,8 на 0,6 см, а на место удаления вшивался фиброиновый имлантат со стволовыми клетками костного мозга. Все животные после операции выжили. А когда через несколько месяцев был проведен гистологический анализ области трансплантации, то место операции можно было обнаружить только по остаткам не рассасывающегося шовного материала.
В области имплантации произошло полное восстановление всех слоев кишечника, формирование слизистой с многочисленными криптами и ворсинками, мышечного слоя поперечными и продольными волокнами, необходимого для перистальтики кишечника, и с кровеносными сосудами. А самое удивительное, что наблюдали исследователи,— это восстановление иннервации кишечника, формирование нервных волокон и нервных сплетений, что ранее считалось недостижимым.
Таким образом, имплантаты из фиброина шелка показали себя идеальным матриксом, обеспечивающим герметичность кишечника и благоприятные механические и физиологические условия для репаративных процессов.
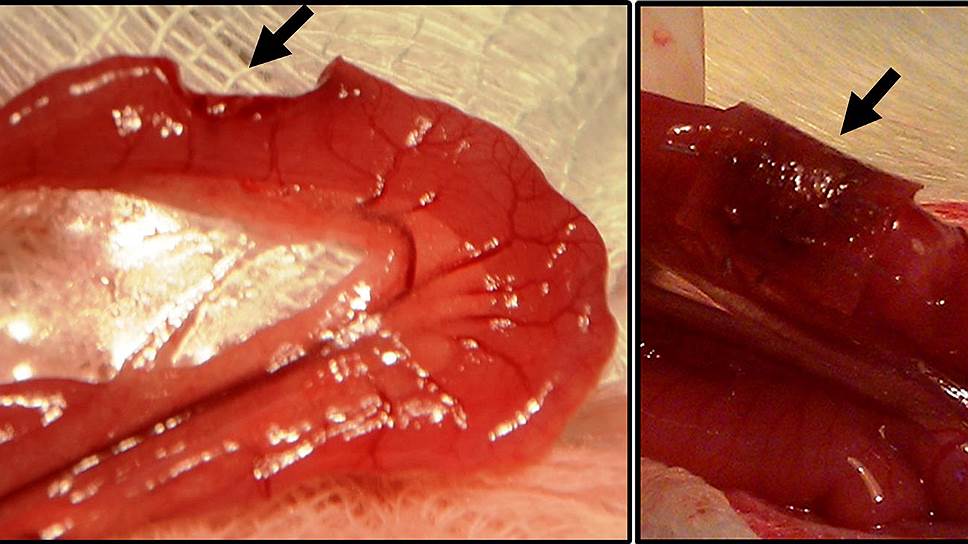
Регенерация стенки тощей кишки крысы с помощью "заплатки" из фиброинового каркаса, витализированного стволовыми клетками костного мозга. Слева — кишечник с удаленным овальным фрагментом. Справа — овальное отверстие закрыто фиброиновым имплантатом, который через три недели разрушается, и на его месте формируется полноценная стенка кишечника
Фото: Из личного архива Анны Гончаренко
Новые трансплантаты — новые вопросы
Можно предположить, что в формировании заново тканей на месте повреждения участвовали как стволовые клетки, внесенные в тканеинженерную конструкцию, так и мигрировавшие сюда из неповрежденных участков тканеспецифичные клетки. Но возможность формирования нейронов de novo в регенерированной ткани до сих пор является спорной.
До недавнего времени возможность нейрогенеза во взрослом организме категорически отрицалась, пока исследования убедительно показали существование в определенных участках мозга стволовых нервных клеток с митотической активностью, то есть делящихся, а следовательно, размножающихся.
Но если с существованием стволовых нервных клеток в нервных тканях ученые легко согласились, то возможность формирования нейронов эктодермального происхождения из стволовых клеток костного мозга мезенхимального происхождения по-прежнему оспаривается.
Эктодерма — это наружный зародышевый листок, из которого формируются эпидермис кожи и нервная система, мезодерма — средний зародышевый листок, дающий начало скелету, мышцам и внутренним органам, а внутренний зародышевый листок энтодерма превращается в клетки, выстилающие изнутри кишечник. Согласно догмату эмбриологии границы между ними нерушимы в ходе развития организма.
Правда, уже есть работы, описывающие не только дифференцировку мезенхимальных стволовых клеток в мезенхимальные клетки, но также в клетки нейроэктодермы и энтодермы. Кроме того, из человеческого кишечника и кишечника грызунов были выделены популяции мультипотентных стволовых клеток, способных дифференцироваться в нейроны и клетки глии. А это значит, что существует по крайней мере гипотетическая возможность нейрогенеза de novo из стволовых клеток костного мозга или из стволовых клеток кишечника, объясняющая столь поразительный успех использования фиброинового скаффолда, заселенного стволовыми клетками костного мозга.
Таким образом, создание новой тканеинженерной конструкции и демонстрация ее возможностей в регенерации кишечника, с одной стороны, открывает перспективы практического использования скаффолдов на основе фиброина в трасплантологии, а с другой — открывает новое направление исследований: поиск новых механизмов регенерации ткани кишечника и роли стволовых клеток в этом процессе.

