Международная группа ученых с участием сотрудников МФТИ объяснила механизм действия перспективных противораковых молекул.
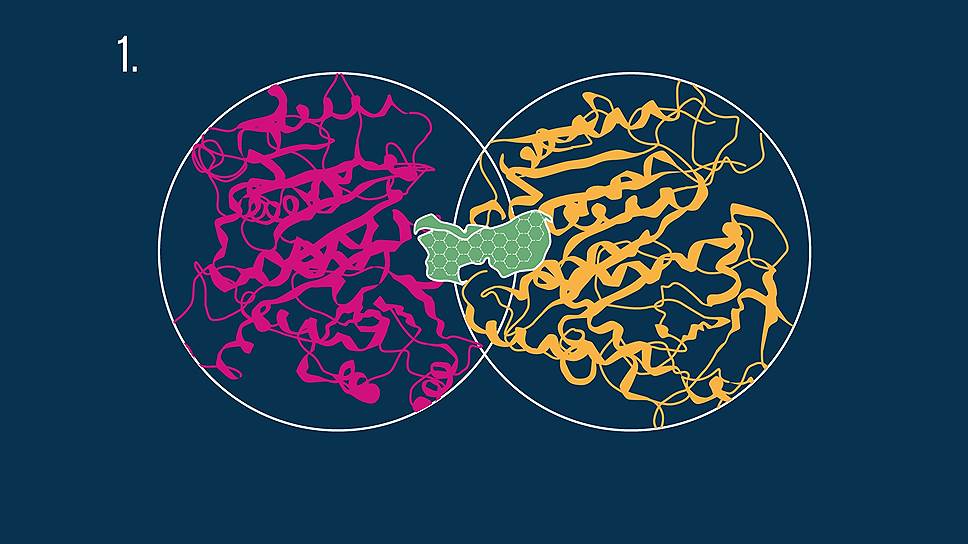
Фото: МФТИ
Полученные результаты помогут модифицировать свойства этих молекул и сделать препараты на их основе безопасными для здоровых клеток. Работа опубликована в журнале Bioorganic & Medicinal Chemistry.
Многие противораковые лекарства разрушают не только опухоль, но и здоровые клетки. Для предотвращения нежелательных эффектов нужно понимать, как такие препараты работают и с чем взаимодействуют.
Коллектив ученых исследовал воздействие веществ класса тиенопиридинов на эмбрионы морских ежей и раковые клетки человека, изучив детали взаимодействия препарата с клеткой с помощью молекулярного моделирования. Было известно, что подобные вещества способны подавлять рост раковых клеток, но механизм этого процесса не был изучен.
"Мы определили, что исследуемые молекулы связываются именно с микротрубочками, а также с помощью молекулярного моделирования уточнили место связывания. На основе этих данных можно улучшить стабильность и селективность молекулы",— комментирует профессор МФТИ Александр Киселев.
Одним из основных принципов действия химиотерапевтических препаратов является разрушение микротрубочек. Микротрубочки играют ключевую роль в митозе — процессе деления клеток — и состоят из двух форм белка тубулина. Такая двойная молекула — димер (см. рис. 1) — имеет три сайта связывания (места взаимодействия с препаратом): колхициновый (отмечен зеленым), таксоловый и винкаалкалоидный.
Авторы статьи подтвердили в экспериментах на живом организме, что исследуемые вещества разрушают микротрубочки, то есть связываются с молекулами тубулина (см. рис. 2, молекула класса тиенопиридинов, связанная с димером тубулина, показана голубым). С помощью молекулярного моделирования ученые определили, что молекулы взаимодействуют с колхициновым сайтом белка.

