Иммунология
Для иммунной терапии не годится, зато годится для аутоимммунной
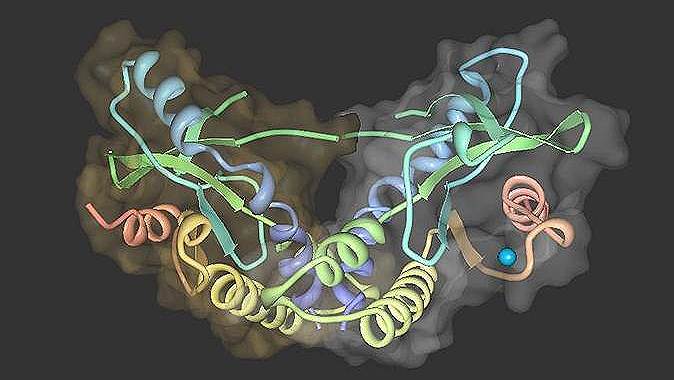
Фото: Wikipedia
Ученые из Петрозаводского университета, Курчатовского института, Института биоорганической химии РАН и Национального научно-практического центра детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева вместе с коллегами из Университета Тафтса (Бостон) открыли новый подход к лечению аутоиммунных заболеваний. Открытие это стало следствием нежелательного побочного эффекта иммунотерапии рака, сообщает журнал Cutting Age: The Journal of Immunology.
Суть иммунотерапии проста: пометить тем или иным способом раковые клетки, чтобы они стали видны иммунной системе,— и клетки-киллеры уничтожат их. Перспективным маркером раковых клеток считалась система STING (Stimulator of Interferon Genes), одна составных частей врожденного иммунитета, в основе которой трансмембранный белок 173. Когда в клетку попадают вирусы (например, гриппа), этот белок заставляет клетку усиленно вырабатывать интерфероны. Интерфероны и сами борются с вирусами, а кроме того, их повышенная концентрация привлекает внимание клеток иммунной системы.
Такие сигнальные свойства STING делают ее идеальным естественным (не синтетическим) маркером раковых клеток, если привязать к ним белок 173. Это удалось сделать в опытах на животных. Но как обнаружила группа российских и американских биологов под руководством профессора Александра Полторака из Петрозаводского университета, одновременно STING может активироваться и в Т-лимфоцитах, координаторах иммунной системы, и включать в них программу апоптоза, то есть самоубийства.
Можно ли приспособить STING к иммунной терапии, непонятно. Зато найден путь для лечения аутоиммунных заболеваний. Эти неизлечимые болезни возникают, когда клетки-киллеры вдруг начинают считать клетки какого-нибудь из органов чужеродным белком и бросаются их убивать. Теперь найдена управа по крайней мере на управляющие Т-клетки, и это настоящий прорыв в аутоиммунной терапии.
Микробиология
Мембранный белок научили производить водород

Фото: Юрий Мартьянов, Коммерсантъ
Ученые МФТИ изобрели способ добычи водородного топлива — экологически чистого и дающего более высокий, чем бензин или солярка, КПД при сгорании. Синтезированные учеными белки в сочетании с популярным фотокатализатором, оксидом титана (TiO2), производят водород из воды просто под действием света.
Прежде получить светочувствительный мембранный белок бактериородопсин можно было из определенного типа мембран микроорганизма Halobacterium halobium. Под действием солнечного света бактериородопсин начинает выкачивать протоны из клетки, и клетка усиленно производит аденозинтрифосфат, главный источник энергии для клетки.
Но теперь есть технологии, позволяющие синтезировать мембранные белки в лабораторных условиях вовсе без участия живых клеток. При помощи специального белка фосфолипиды заключаются в так называемые нанодиски, благодаря чему обретают целостную форму и способность к фотокатализу. А во взаимодействии с другим светочувствительным веществом — диоксидом титана — липид-белковые нанодиски значительно усиливают свою фотокаталитическую способность.
Нанодиски поместили вместе с диоксидом титана в водный раствор, добавили туда же платину, улучшающую фотокатализ. За считанные часы диоксид титана и нанодиски слипались друг с другом — белок бактериородопсин впитывал свет и передавал энергию диоксиду титана, а также переносил протоны, отделившиеся за счет платинового катализатора при реакции восстановления. Чтобы восстановление происходило более динамично, ученые добавили в раствор небольшое количество метилового спирта, служившего источником электронов для свободных протонов, образовывавшихся при восстановлении. Для контроля получившуюся смесь вначале осветили зеленым светом, и смесь выделила небольшое количество водорода. Затем смесь поместили под белый свет, под которым водород непрерывно выделялся на протяжении двух-трех часов, и выделилось его примерно в 74 раза больше, чем при зеленом освещении.
Офтальмология
Биоразлагаемый протез для лечения глаукомы
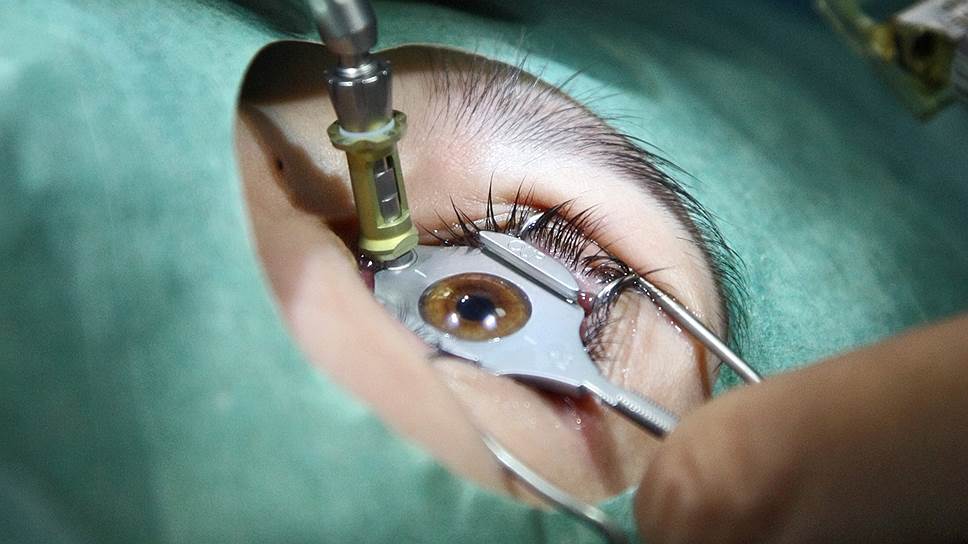
Фото: Юрий Мартьянов, Коммерсантъ
В Новосибирском филиале МНТК "Микрохирургия глаза" им. академика С.Н. Федорова разработан первый в мире биоразлагаемый микропротез для лечения глаукомы.
Глаукома — прогрессирующее заболевание, приводящее к необратимой слепоте. Повышенное внутриглазное давление при глаукоме постепенно разрушает клетки сетчатки, атрофируется зрительный нерв, и сигналы от глаза перестают поступать в головной мозг. Человек начинает видеть все хуже и хуже, пока совсем не слепнет.
Один из создателей микропротеза, директор Новосибирского филиала, профессор Валерий Черных сообщил, что операция вживления отечественного импланта будет вдвое или даже втрое дешевле, чем импортного. При лечении глаукомы необходимо создать искусственный дренаж для оттока внутриглазной жидкости, чтобы снизить внутриглазное давление. Операция стандартная, но импортный имплант в течение пяти лет зарастает, отток жидкости прекращается, 30% операций с его применением неэффективны. Поэтому обновлять имплант, по словам профессора Черных, необходимо примерно раз в пять лет.
Отечественная же разработка представляет собой биоразлагаемый дренаж, который состоит из двух полимеров: искусственного капролактама и натурального коллагена, микропротез максимально приближен по составу к тканям глаза и в течение четырех месяцев разлагается, а к этому времени у пациента с помощью протеза формируется новый, незарастающий канал для оттока глазной жидкости.

