Нобелевскими лауреатами 2019 года по физиологии и медицине стали Уильям Кэлин (США), сэр Питер Рэтклифф (Великобритания) и Грегг Семенза (США) за открытие молекулярного механизма реакции клетки на кислород. Их премия стала третьей по счету Нобелевской премией за открытия в области клеточного дыхания.
Фото: Reuters
Фото: Reuters
В 1931 году Нобелевскую премию получил немецкий биохимик Отто Варбург за открытие белков — ферментов, которые обеспечивают процесс клеточного дыхания — расщепления биополимеров до воды и углекислого газа с использованием кислорода. В 1938 году нобелевским лауреатом стал бельгийский физиолог Корней Хейманс, который в опытах на собаках установил, что периферические рецепторы играют основную роль в регуляции частоты дыхания, а значит, и количества кислорода в крови.
Тогда же, в 1930-е годы, стал окончательно понятен механизм реакции на недостаток кислорода на уровне организма. В ответ на хронический недостаток кислорода в клетках и тканях организм вырабатывает гормон — эритропоэтин, в крови увеличивается число красных кровяных клеток эритроцитов, переносчиков кислорода с кровью от органов дыхания к тканям. А третья Нобелевская премия за дыхание была вручена за раскрытие молекулярного механизма реакции клеток на недостаток кислорода.
Работая параллельно и независимо друг от друга на генетически модифицированных мышах и на культуре клеток печени, Питер Рэтклифф и Грегг Семенза обнаружили, что механизм ответа на недостаток кислорода одинаков во всех тканях, а не только в почках и печени — основных источниках эритропоэтина, а мутации в регуляторной области гена эритропоэтина приводят к развитию кислородного голодания — гипоксии.

Питер Рэтклифф
Фото: Reuters
Питер Рэтклифф
Фото: Reuters
Продолжая исследования, Грегг Семенза открыл индуцируемый гипоксией фактор (HIF), он обнаружил, что HIF состоит из двух различных ДНК-связывающих белков, так называемых транскрипционных факторов, HIF-1-альфа и ARNT. Оказалось, что HIF, связываясь с геном эритропоэтина, усиливает его наработку. Оставался нерешенным вопрос — как HIF определяет момент, когда нужно активировать ген эритропоэтина.
Было известно, что белок HIF-1-альфа, находясь в цитоплазме, постоянно утилизируется в протеасомах, из-за этого в норме его очень мало. При гипоксии HIF-1-альфа приобретает защиту от протеасомной деградации — с него пропадает убиквитиновая метка. Но как это происходит?

Грегг Семенза
Фото: REUTERS/Theresa Keil, Reuters
Грегг Семенза
Фото: REUTERS/Theresa Keil, Reuters
Подсказка, которая помогла найти ответ на этот вопрос, была получена Уильямом Кэлином в ходе исследования болезни Гиппеля-Линдау. Это генетическое заболевание приводит к повышенному риску онкологических заболеваний на фоне мутаций в гене, который кодирует белок VHL. В отсутствие белка VHL в опухолях активировались гены, связанные с гипоксией, а при его возвращении в клетку эти гены подавлялись. Исследователям удалось показать, что белок VHL способен взаимодействовать с HIF-1-альфа, метить его убиквитином, что и требуется для его деградации в норме.
Оставался неясным один вопрос: чем белок HIF-1-альфа при нормоксии отличается от белка HIF-1-альфа при гипоксии. В 2001 году Рэтклифф и Семенза одновременно опубликовали статьи, обнаружив, что при нормальном количестве кислорода происходит модификация белка HIF-1-альфа — пролилгидроксилирование, что позволяет белку VHL узнать и связать HIF-1-альфа. При недостатке кислорода этот процесс нарушается, и HIF-1-альфа идет в ядро клетки.
Реакция клетки на кислород
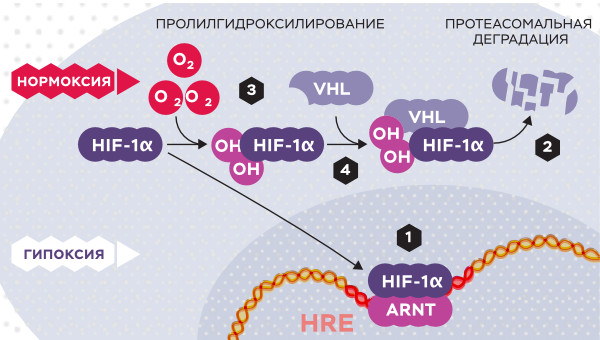
Когда уровень кислорода (О2) низок (гипоксия), белок HIF-1-альфа защищен от деградации и накапливается в ядре, где он связывается с белком ARNT и связывается со специфическими последовательностями ДНК (HRE) в генах, регулируемых гипоксией (1). При нормальном уровне кислорода HIF-1-альфа быстро деградируется протеасомой (2). Кислород регулирует процесс деградации путем добавления гидроксильных групп (OH) к HIF-1-альфа (3). Белок VHL может затем образовывать комплекс с HIF-1-альфа, что приводит к его деградации кислородзависимым способом (4)
Рисунок: Иллюстратор: Маттиас Карлен, Нобелевский комитет по физиологии и медицине.
В 2016 году трио Кэлин, Рэтклифф и Семенза получило премию Ласкера, ее присуждают в США за фундаментальные медицинские исследования, и она уже стала своего рода предсказанием, что ее обладатель в скором времени получит Нобелевскую премию. Во всяком случае, более 80 лауреатов премии Ласкера стали нобелевскими лауреатами. Так что вручение Нобелевской премии по физиологии и медицине именно этому коллективу ученых было ожидаемо.

Уильям Кэлин
Фото: REUTERS/Brian Snyder, Reuters
Уильям Кэлин
Фото: REUTERS/Brian Snyder, Reuters
Сейчас много пишут и говорят о том, что открытие молекулярного механизма клеточной гипоксии открывает новые возможности для лечения рака. Об этом же сказано в пресс-релизе Нобелевской ассамблеи шведского Каролинского института (The Nobel Assembly at Karolinska Institute), которая, собственно, и присуждает Нобелевские премии по физиологии и медицине.
Все это верно, только, наверное, не стоит забывать одну деталь. Первым идею о том, что клетки злокачественных опухолей можно и нужно в буквально смысле душить контролируемой гипоксией, еще больше полувека назад высказал Отто Варбург, лауреат самой первой премии за клеточное дыхание. Сказал он об этом и предложил свой вариант «удушения» раковых клеток в 1966 году в лекции на встрече нобелевских лауреатов в Линдау на берегу Боденского озера.
Его алгоритм борьбы с раковыми клетками в итоге оказался бесперспективным, но сам подход к проблеме остался верным, а теперь снова приобрел актуальность.
Вся история открытия говорит о важности процесса адаптации к гипоксии клеток при канцерогенезе, такие состояния возникают при атеросклерозе, инсульте, ишемии, при инфекциях и просто интенсивных нагрузках.
И сейчас окончательно стало понятно, в каких случаях нужно бороться с гипоксией, в каких ее усиливать и, главное, на какие мишени нужно воздействовать. А это позволяет рассчитывать на появление нового класса противораковых препаратов и разработку новых подходов к борьбе с кислородным голоданием клетки при других недугах

