Зачем клетки липнут друг к другу
Что такое внеклеточный матрикс и как он участвует в жизни организма
Все слышали о том, что организм состоит из клеток, но не все задумывались, как они организуются и работают. Все клетки нашего организма на той или иной стадии своего развития растут и живут в адгезивном (прикрепленном) состоянии.

Елена Петерсен
Фото: Андрей Афанасьев, Коммерсантъ
Елена Петерсен
Фото: Андрей Афанасьев, Коммерсантъ
Адгезия, или налипание,— важное свойство наших клеток, которое обеспечивает организму многоклеточное существование. «Прилипая» друг к другу и к внеклеточным структурам, клетки объединяются в одни органы и отделяются от других. В этом им помогает внеклеточный матрикс. Как все это работает, объясняет Елена Петерсен, кандидат медицинских наук, доцент, заведующая лабораторией молекулярно-биологических и нейробиологических проблем и биоскрининга МФТИ.
Много гиалуроновой кислоты не всегда хорошо
Внеклеточный матрикс (ВКМ) — это совокупность структурных белков, образующих фибриллярный (нитевидный) каркас органов и тканей. Внешне ВКМ можно представить себе в виде сетки, повторяющей очертания органа и его структурных элементов. Клетки же, в свою очередь, группируются определенным образом на различных сторонах этой сетки, образуя ткани, а все вместе они образуют органы.
В зависимости от типа ткани и органа состав и строение ВКМ изменяется. Так, мы знаем, например, что для кожи доминирующие типы коллагена — это 1 и 3, а для хрящевой ткани — 2. Также ВКМ меняется в зависимости от возраста и состояния организма. Например, по мере развития эмбриона вокруг его клеток формируется первичный матрикс, который больше напоминает не фибриллы, а нежный гидрогель или желе. Состоит он преимущественно из гиалуроновой кислоты.
Такое строение первичного внеклеточного матрикса позволяет клеткам активно перемещаться, выстраивая цепочки, которые двигаются в определенном направлении и образуют новые ткани растущих органов. Взаимодействуя с мезенхимальными стволовыми клетками, жесткий ВКМ может изменить конечную дифференцировку по хондрогенному (хрящевому) или остеогенному (костному) направлению.
С возрастом процент гиалуроновой кислоты в составе тканей снижается, клетки экспрессируют (создают) вокруг себя фибриллярные (нитевидные) белки, в основном коллаген и эластин, которые образуют сетчатый внеклеточный матрикс, замещающий собой первичный и обеспечивающий большую прочность тканям и органам.
Но в ряде случаев — например, при раковой прогрессии — происходит увеличение процента гиалуроновой кислоты в ткани, раковые клетки активно синтезируют ее. Такое повышение ничего хорошего не предвещает. Это один из неблагоприятных диагностических маркеров. То есть много гиалуронки не всегда хорошо.
В последние десять лет стало понятно, что значение ВКМ гораздо более важное, чем простая поддержка органов и ограничение их структуры. Он также выполняет ключевые функции в регуляции клеточной активности и важен для множества биологических процессов за счет связанных с ним сигнальных молекул, влияющих на клеточное поведение, включая самоподдержание нормального количества клеток, сохранение их «молодости» и «работоспособности».
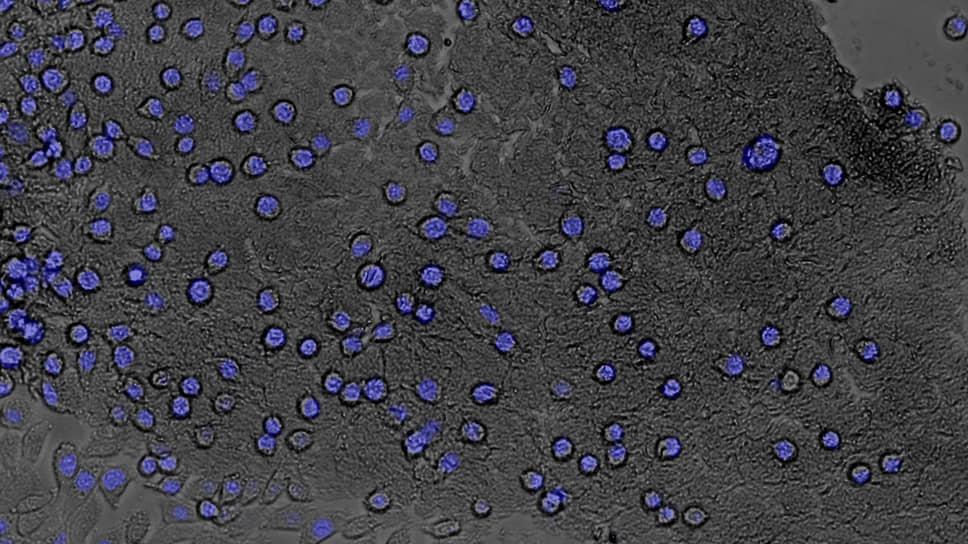
ВКМ мозга с растущими на нем клетками (синим красителем окрашены клеточные ядра)
Фото: Коммерсантъ
ВКМ мозга с растущими на нем клетками (синим красителем окрашены клеточные ядра)
Фото: Коммерсантъ
Что подложить под клетку
Начиная с 1970–1980-х годов с подъемом клеточных технологий первой волны начали появляться реферируемые статьи об использовании клеток для лечения ран. В первую очередь речь велась о заживлении ран и ожогов кожи. Для этого использовали клетки, получаемые из кусочка тканей самого пациента или донора, которые в условиях лаборатории росли прикрепленными в специальной емкости, а для дальнейшего использования после нарастания нужного количества их нужно было открепить.
Делали это с помощью различных ферментов или скребков, что могло травмировать клетки. Сами клетки, будучи открепленными от дна своих емкостей, могли погибать при транспортировке и хранении перед нанесением их на рану.
Решением этого вопроса было использование подложек — вкладок в специальную посуду для выращивания клеток, на которых они могли расти, после чего вместе с этой подложкой переноситься на рану. В виде таких подложек использовались всевозможные материалы — от синтетических до природных. В частности, искусственно синтезированные — например, поливинилхлоридные пленки, а также естественные матриксы из различных тканей (подслизистая тонкого кишечника, дерма кожи, губчатое вещество кости). По мере накопления опыта использования различных подложек стало понятно, что они все обладают различным действием на клетки.
Конечно, мы узнали, какие материалы лучше не использовать из-за их токсичности: к ним клетки не могли прикрепляться или расти на их поверхности. Ряд материалов вызывал воспаление при помещении в рану пациента. Но помимо этого было обнаружено, что использование, казалось бы, биологически совместимых материалов может менять клетки, которые с ними взаимодействуют, превращая их, например, в рубцовые. Еще одним результатом стал подъем научного интереса к натуральным подложкам из тканей и органов, в результате чего появилась технология децеллюляризации тканей.
Децеллюляризация — это обработка тканей, когда с помощью специальных растворов вымывают клетки из этой ткани, оставляя только ВКМ. Технология начала развиваться как альтернатива трансплантации органов, где использовался донорский орган для пересадки. Всем известно, что в трансплантологии всегда существует нехватка донорских органов для пересадки: необходимо подобрать орган, который максимально подходит реципиенту по иммунным антигенам и не будет отторгаться, кроме того, он должен иметь достаточное количество живых клеток в хорошем состоянии. В некоторых случаях здоровые органы попадают к трансплантологам после оптимального срока своего хранения, когда начинается процесс клеточного отмирания.
Идея технологии заключалась в том, чтобы иметь возможность использования этого донорского материала, для чего умирающие и чужеродные клетки нужно удалить с помощью отмывок специальными растворами (процесс децеллюляризации), а потом заселить живыми клетками (процесс рецеллюляризации).
Возраст влияет
Реализация технологии оказалась более сложной, чем это предполагалось сначала. Эффективного заселения клетками (рецеллюляризации) пока добиться не удалось, но первая половина, связанная с мягкими отмывками, нашла свое применение. В медицине используются различные материалы животного происхождения, костная стружка, связки, сердечные клапаны для замещения поврежденных тканей у человека. Эти материалы представляют собой стерилизованные высушенные ткани и называются ксеногенными (полученными от животного) протезами.
Исследования показали, что содержащиеся в них клеточные обломки могут приводить к отложению кальцификатов через несколько лет после имплантации. В то же время использование метода децеллюляризации тканей, составляющих ксеногенные протезы, позволяет избежать этой воспалительной реакции, поскольку ВКМ сам по себе низкоиммуногенный и не вызывает воспаления. Но все эти правила касаются ВКМ, полученного от молодого и здорового организма.
С возрастом меняется работа наших клеток, в том числе связанная с поддержанием нормального круговорота структурных белков ВКМ. Клетки начинают меньше синтезировать новые структурные белки и ферменты, приводящие к утилизации старых и поврежденных фибрилл.
Кроме того, различные внешние воздействия, такие как солнечная радиация, влияние продуктов перекисного окисления, поступление большого количества сахаров с пищей либо заболевания (например, сахарный диабет), могут приводить к появлению AGE-продуктов (Advanced Glycation End-products, или «конечные продукты гликирования» — это продукты, образованные присоединением сахаров к белкам или жирам).
В настоящий момент описано более 30 различных AGE-продуктов, поскольку они могут получаться при гликировании различных структур как внутри клетки, так и вне ее. Основная проблема, связанная с этими конечными продуктами гликирования, заключается в том, что они блокируют работу тех структур, в которых они «накопились». Снижается энергетический уровень клеток, поскольку они могут образовывать комплексы в мембране митохондрий, нарушаются многие обменные процессы, связанные с клеточной мембраной. С появлением продуктов гликирования мембрана становится менее текучей, это мешает работе рецепторов и транспортных белков клетки.
На уровне ВКМ также происходит ухудшение нормального функционирования. Возникающие сшивки делают сетчатый матрикс менее эластичным, из-за чего возникают микроразрывы фибриллярных белков, которые приводят к образованию очагов хронического воспаления.
В ответ на эти повреждения запускается процесс синтеза новых матриксных белков, но он не может полностью компенсировать урон, полученный при повреждении, поскольку просто увеличивает плотность и жесткость матрикса.
На уровне, видимом клиницистам, эти проявления выражаются в появлении фиброза миокарда, скелетной мускулатуры, ригидности (потере эластичности) сосудистой стенки, наблюдается рост атеросклеротических бляшек, растет общая утомляемость, развивается воспаление суставов и так далее. Одним словом, влияние AGE определяется как один из главных факторов старения и целого ряда хронических заболеваний. Мы исследуем закономерности по ряду заболеваний, где различные продукты накопления, в том числе продукты гликирования, могут влиять на исход их течения или менять чувствительность к проводимой терапии.
Модель, с которой все быстро и просто
В МФТИ всегда много занимались решением сложных комплексных задач в биологии и медицине, созданием новых подходов и приборных решений. А мы в своей работе большое внимание уделяем не только генетической и химической составляющей тех экспериментальных моделей, которые разрабатываем, но и оценке физических характеристик изучаемого нами ВКМ.
Мы оцениваем совокупность характеристик, включая жесткость матрикса, которая может динамически меняться по мере накопления патологических (связанных с развитием болезни) продуктов и оказывать дополнительное влияние на клетки наших моделей. Используем вычислительные мощности кластера для расчета и прогнозирования негативного исхода различных заболеваний и вместе с инженерами разрабатываем лабораторные стенды для моделирования различных процессов.
Работа со сложными экспериментальными моделями требует более тщательного приборного контроля воссоздания естественных условий. Также важно попытаться максимально снизить погрешности, связанные с различными условиями и временем проведения эксперимента. Предложенная мной идея параллельного биоскрининга, когда работа максимально синхронизируется и проводится на клеточных, тканевых и животных моделях (для этого мы используем животную модель рыбок Danio Rerio) одним потоком, получила поддержку у руководства института, что и послужило толчком к открытию лаборатории.
Несмотря на то что накоплен большой объем знаний о ВКМ, до сих пор остается много неизвестного о свойствах именно патологически измененного матрикса: о том, какие могут быть сочетанные эффекты, влияние на работу клеток, с которыми он взаимодействует; какие могут быть неблагоприятные события при тех или иных изменениях; какие сочетания и варианты измененного матрикса можно оценивать как маркеры значимого ухудшения состояния и здоровья человека, нужно ли менять схему лечения и препараты выбора…
Наша лаборатория занимается созданием сложных клеточных модельных систем для изучения клеточно-клеточных и клеточно-матриксных взаимодействий. Упрощенно говоря, мы записываем сдвиги в нормальной реакции клеток на лекарства при их дополнительном взаимодействии с различными клетками и матриксами, которые их могут окружать в организме человека, потом создаем «дорожную карту» этих сдвигов.
Так, например, мы разработали и описали трехмерную клеточную модель миграции клеток из сфероида, пригодную для оценки и подбора противоопухолевой терапии, подобрали параметры наблюдения и методы неразрушающего контроля за клеточным поведением в зависимости от добавляемых лекарств.
Оригинальность и важность нашей работы в том, что мы разработали модель, удобную для скрининговой оценки: наша методика отличается скоростью получения результата, простотой использования и универсальностью. Мы можем анализировать влияние противоопухолевых средств на различных типах раковых клеток, моделировать сoлидные (плотные) опухоли, оценивать вероятность инвазивного (прорастающего в другие ткани) роста и образования вторичных метастазов.
Мы описали первые изменения, которые происходят за несколько часов, в то время как существующие альтернативные модели описывают суточные изменения. Кроме того, мы умеем оценивать влияние клеток опухолевого окружения и матрикса пациента и вклад этих параметров в нашу модель, что делает тестирование более точным, а результат — максимально приближенным к реакции клеток самого пациента.
Наша система может быть использована для подбора терапевтических противоопухолевых средств, начиная от подбора индивидуальной чувствительности известных препаратов и заканчивая разработкой и тестированием новых средств как химической и физической, так и генетической терапии.
Мало того: наша разработка уже применяется в исследовательском проекте РНФ совместно с нашими коллабораторами из Института кластерной онкологии имени профессора Л. Л. Левшина Сеченовского университета под руководством академика РАН, профессора Игоря Решетова. Надеюсь, наша модель сможет послужить целям развития прецизионной диагностики и более эффективного лечения пациентов.

